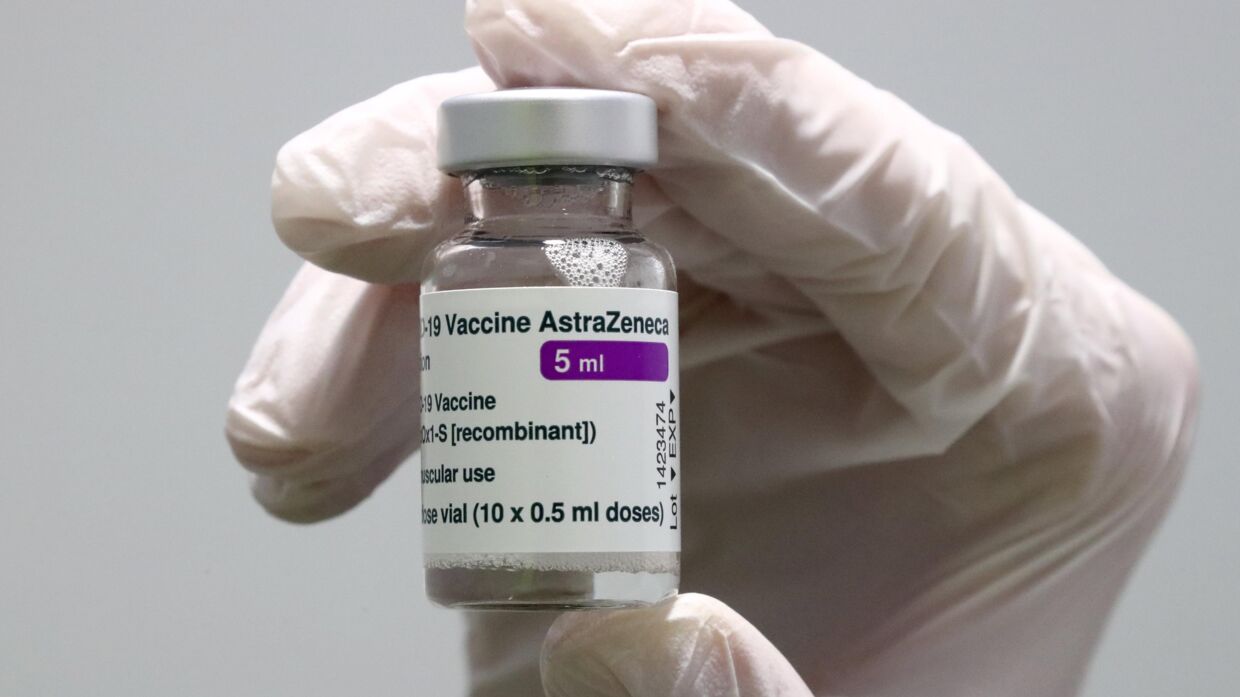
AstraZeneca er efter ønske fra europæiske sundhedsmyndigheder ved at opdatere deres produktinformation.
Vaccineproducenten AstraZeneca er i samarbejde med myndighederne ved at opdatere produktinformationen om mulige bivirkninger af deres vaccine.
Og de "arbejder allerede for at forstå de konkrete sager, epidemiologien og mulige mekanismer, der kan forklare disse ekstremt sjældne tilfælde".
Det oplyser medicinalvirksomheden i en pressemeddelelse efter onsdagens melding fra Det Europæiske Lægemiddelagentur, EMA.
EMA sagde tidligere onsdag, at de ser en mulig forbindelse mellem AstraZenecas covid-19 vaccine og sjældne tilfælde af en kombination af usædvanlige blodpropper, blødninger og et lavt antal blodplader.
Sabine Straus, der er formand for EMA's sikkerhedskomité, siger på et pressemøde, at den omtalte risiko ved AstraZenecas vaccine synes at være størst for yngre og kvinder. Hun understreger, at bivirkningerne er ekstremt sjældne.
AstraZeneca skriver, at deres covid-19-vaccine tilbyder modtageren et højt niveau af beskyttelse mod coronavirusset. Fordelene ved coronavaccinen overstiger "betragteligt" risikoen for bivirkningerne, mener AstraZeneca.
Statsepidemiolog Ulla Wändel Liminga fra Sveriges lægemiddelstyrelse oplyser, at en ny produktinformation vil blive brugt til coronavaccinerne fra AstraZeneca.
Den vil fortælle, at kombinationen af blodpropper og lave niveauer af blodplader er "meget sjældne", siger Wändel Liminga ifølge nyhedsbureauet TT.
Over 34 millioner mennesker i Storbritannien og EU har modtaget vaccinen fra AstraZeneca, skriver virksomheden i pressemeddelelsen.
I Danmark har Sundhedsstyrelsen foreløbig sat AstraZeneca-vaccinen på pause indtil 15. april.
Lægemiddelstyrelsen tager i en pressemeddelelse onsdag aften ikke stilling til, om udmeldingen fra EMA får betydning for den danske vaccination med AstraZenecas vaccine.
/ritzau/